· Осмотический. Проявляется накоплением в организме осмотически активных веществ (накопление ионов натрия вследствие его усиленной реабсорбции в почечных канальцах). Этот механизм является компенсаторным при гиповолемии и снижении артериального давления. Отек возникает, если этот синдром развивается на фоне нормального или увеличенного ОЦК (снижение венозного выброса при болезнях сердца, нарушение клубочкового кровотока при болезнях почек, при портальной печеночной гипертензии). При сокращении клубочкового кровотока происходит активация ренин-ангиотензин-альдостероновой системы. В кровь из юкстагломерулярных клеток поступает ренин. В результате ограниченного протеолиза ангиотензиноген превращается в ангиотензин I и в легких в ангиотензин II, который активирует выработку альдостерона клубочковой зоной коры надпочечников. Альдостерон усиливает реабсорбцию натрия в дистальных отделах почечных канальцев, что приводит к гиперосмии внутренней среды. Это приводит к выделению вазопрессина, который увеличивает реабсорбцию воды адекватно натрию. Избыточная изоосмотическая жидкость накапливается в межклеточных пространствах и формируются отеки.
· Онкотический. Проявляется снижением онкотического давления крови вследствие гипопротеинемии. Причинами могут быть: нефротический синдром (потеря белка с мочой), обширные ожоги (плазморея), тяжелые поносы (избыточное выведение белка), белковое голодание (недостаток поступления белка). При этом под действием гидростатического давления жидкость покидает сосуды в артериальном конце капилляра, но в венозном конце не может вернуться в сосуд из-за низкого онкотического давления. При этом развиваются системные отеки (анасарка), накопление жидкости в серозных полостях (брюшной, плевральной, перикардиальной).
· Блокада лимфооттока. Повышение давления в крупных венозных сосудах сопровождается рефлекторным спазмом соответствующих лимфатических сосудов – давление в них повышается и отток лимфы блокируется (рефлекс Русняка-Петровского). Этот механизм присутствует при наследственной недостаточности лимфатических капилляров – элефантиазис (слоновость).
· Гидростатический (застойный). Проявляется повышением гидростатического давления в капиллярах. Этот механизм играет ведущую роль при застое малого круга (стеноз левого атриовентрикулярного отверстия, левожелудочковая недостаточность), портальной гипертензии (цирроз печени), правожелудочковой недостаточности (повышение давления в капиллярах печени), переливании жидкостей через крупные вены (подключичная, яремная) под большим давлением. Повышение гидростатического давления способствует фильтрации и препятствует реабсорбции, что приводит к накоплению жидкости в межклеточном пространстве.
· Эндотелиальный. Проявляется накоплением БАВ, увеличивающих сосудистую проницаемость. Причины: воспаление, ишемия и гипоксия, аллергические реакции, механическая травма, экзотоксины (укусы змей, насекомых, действие боевых отравляющих веществ). Механизм: БАВ (гистамин, брадикинин, простогландины, тромбоксаны) воздействуют на эндотелиоциты и приводят к их сокращению. Это увеличивает межэндетелиальные щели и белки крови могут проникать в межклеточную жидкость, что приводит к увеличению онкотического давления межклеточной жидкости, которое удерживает воду и препятствует ее возвращению в сосуд.
Микседематозный отек. Микседема – особый вид отека, характерный для гипотиреоза.
Механизмы возникновения:
· Увеличение гидрофильности соединительной ткани из-за накопление в ней глюкуроновой и хондроитинсерной кислот, накопление в клетках и интерстициальной жидкости натрия в связи со снижением выработки предсердного натрийуретического фактора.
· Задержка жидкости в организме в связи с повышением эффектов АДГ в условиях гипофункции щитовидной железы
· Связывание жидкости тканевым коллоидом с образованием муцина – слизеподобного соединения, что приводит к утолщению кожи и подкожной клетчатки (кожа не собирается в складки, сухая, холодная, бледная с желтоватым оттенком).
Развивается одутловатость (отечность) лица, понижение мимики, отек периорбитальной клетчатки.
Отечная жидкость происходит, как и лимфа, из крови. Диффузия воды через стенку капилляров совершается на всем их протяжении.
Интенсивный транскапиллярный обмен воды и электролитов не отражается на их распределении между кровью и внесосудистым пространством, так как совершается с одинаковой скоростью в обоих направлениях. Наряду с транскапиллярным переходом воды путем диффузии существует направленный переход воды из крови во внесосудистое пространство. Этому процессу способствует гидродинамическое давление крови, определяемое величиной кровяного (гидростатического) давления и скоростью кровотока в капиллярах, а также онкотическое (коллоидно-осмотическое) давление белков тканевой жидкости. Противодействуют выходу жидкости онкотическое давление белков крови и гидростатическое тканевое давление. Величина онкотического давления зависит от концентрации белков (поэтому она больше в крови, чем в тканевой жидкости) и от соотношения между белковыми фракциями (максимальна у альбумина и минимальна у фибриногена). Несмотря на малую величину (25-30 мм рт. ст.), онкотическое давление крови имеет несравненно большее значение для удержания воды внутри сосудистого русла, чем осмотическое давление растворенных в плазме низкомолекулярных веществ. Объясняется это тем, что капилляры функционируют как полупроницаемые мембраны, через которые белки проникают плохо, а кристаллоиды - легко. Поэтому концентрация кристаллоидов в плазме и тканевой жидкости почти одинакова. В артериальном конце капилляра гидростатическое давление преобладает над онкотическим, поэтому вода с кристаллоидами и небольшим количеством белка переходит из крови в ткани (рис. 1). В венозном конце капилляра в результате понижения кровяного давления преобладает величина онкотического давления и поэтому происходит всасывание воды и растворенных в ней кристаллоидов из тканей в кровь. В нормальных условиях избыток воды, кристаллоидов и белков, не резорбировавшихся в венозном конце капилляра, поступает в лимфатические капилляры (рис. 2) и уносится из ткани.
Рис. 1. Схема обмена жидкостью между капиллярами и тканью.
Рис. 2. Направление движения воды, кристаллоидов и белков через стенки кровеносных (1) и лимфатических (2) капилляров.
Усилению перехода жидкости из крови в ткани способствует повышение гидродинамического давления крови и пониженно ее онкотического давления. Возникновению местных отеков, кроме того, способствует повышение проницаемости капилляров и венул для белков Любая из перечисленных причин может вести к возникновению О., если отток избытка жидкости по лимфатическим капиллярам недостаточен. В патогенезе отеков различного происхождения играет роль задержка натрия в организме (раньше ей придавали значение в основном при почечных О.) При сердечно-сосудистой недостаточности, заболеваниях печени, почек усиливается секреция альдостерона в коре надпочечников. Вследствие этого увеличивается реабсорбция натрия в дистальных почечных канальцах и повышается концентрация его в крови. Возникают гиперосмия и раздражение осморецепторов, вследствие чего усиливается поступление в организм антидиуретического гормона (АДГ) из задней доли гипофиза. В результате этого увеличивается эффективный объем плазмы, нарастает венозное и капиллярное давление и усиливается транссудация.
Патогенез отёков при сердечной недостаточности представлен на рисунке.
При чина: сердечная недостаточность (состояние, при котором сердце не обеспечивает потребности органов и тканей в кровоснабжении, адекватном их функции и уровню пластических процессов). Она характеризуется:
— меньшей (по сравнению с потребной) величиной сердечного выброса;
— первично циркуляторной гипоксией.
Инициальный патогенетический фактор - гидродинамический.
— Причины включения гидродинамического фактора:
— Системное повышение венозного давления в связи со снижением сократительной функции сердца.
— Увеличение ОЦК. Это наблюдается при хронической сердечной недостаточности, закономерно сопровождающейся развитием циркуляторной гипоксии - при хронической гипоксии наблюдается эритро-цитоз и как следствие - увеличение ОЦК.
— Механизмы реализации:
— Торможение резорбции жидкости из межклеточного пространства в венозной части капилляров. Это является результатом повышения в них венозного давления и как следствие - эффективного гидростатического давления.
— Увеличение фильтрации жидкости в артериальной части капилляров. Последнее обусловлено повышением в артериальном участке микрососудистого русла эффективного гидродинамического давления в связи с возрастанием (за счёт эритроцитоза в условиях гипоксии) ОЦК.
Патогенез отёка при сердечной недостаточности. РАА- система «ренин-ангиотензин-альдостерон»; ЭДГ - эффективное гидростатическое давление; ЭОВС - эффективная онкотическая всасывающая сила.
Последовательность включения и значимость других патогенетических факторов отёка в каждом конкретном случае могут быть различными в зависимости от динамики расстройств кровообращения и их последствий. В любом случае патогенез сердечного отёка включает рассмотренные ниже звенья.
— Активация барорецепторов в стенке кровеносных сосудов.
— Причина: уменьшение сердечного выброса и ОЦК.
— Механизмы реализации:
— Сужение артериол коркового вещества почек.
— Увеличение тока крови в мозговом веществе почек.
— Усиление канальцевой реабсорбции ионов Na+, что приводит к гиперосмии крови.
— Активация осморецепторов.
— Усиление синтеза и высвобождения в кровь АДГ.
— Возрастание реабсорбции воды в почках.
— Увеличение эффективного гидродинамического давления.
— Активация фильтрации жидкости в артериальном регионе капилляра, сочетающаяся с торможением реабсорбции воды в венозном отделе микрососудов. Как первое, так и второе обусловливают развитие отёка.
— Уменьшение объёма кровотока в сосудах почек.
— Причина: снижение величины сердечного выброса.
— Механизмы реализации .
— Активация системы «ренин-ангиотензин-альдостерон».
— Усиление реабсорбции Na+ в канальцах почек.
— Развитие механической лимфатической недостаточности.
— Причина: снижение сердечного выброса.
— Механизмы реализации .
— Нарушение оттока венозной крови от тканей к сердцу.
— Системное увеличение венозного давления, как центрального, так и в периферических венозных сосудах.
— Торможение оттока лимфы от тканей - развитие механической лимфатической недостаточности.
— Увеличение объёма интерстициальной жидкости, т.е. степени отёка.
— Увеличение осмотического давления в тканях.
— Причины .
— Нарушение оттока осмотически активных веществ (ионов, неорганических и органических соединений) в результате венозного застоя (венозной гиперемии) и лимфатической недостаточности.
— Увеличение концентрации метаболитов (например, молочной и пировиног-радной кислот, пептидов, аминокислот) в связи с нарушением обмена веществ в условиях гипоксии.
— Механизм реализации: ток жидкости из микрососудов в интерстиций по градиенту осмотического давления.
— Нарушение системного кровообращения с развитием циркуляторной гипоксии и ацидоза.
— Причина возникновения гипоксии и ацидоза: уменьшение сердечного выброса.
— Механизмы реализации .
— Повышение проницаемости лизосом и высвобождение из них гидролитических ферментов. Ферменты гидролизуют основное вещество и волокна соединительной ткани в стенке сосудов. В связи с этим увеличивается их проницаемость для воды, что потенцирует развитие отёка.
— Активация неферментного гидролиза компонентов базальной мембраны стенок микрососудов. Это также приводит к повышению их проницаемости.
— Увеличение образования и активности БАВ, повышающих проницаемость стенок микрососудов (например, гистамина, серотонина, кининов, отдельных факторов комплемента).
— Повышение выхода белка из крови в интерстициальное пространство.
— Нарушение (в условиях недостаточности кровообращения) белоксинтетичес-кой функции печени, ведущее к гипоальбуминемии.
— Снижение эффективной онкотической всасывающей силы .
— Усиление тока воды из микрососудов в межклеточное пространство по возросшему градиенту онкотического давления.
— Развитие застоя крови в сосудах печени и нарушение её кровоснабжения.
— Причина: уменьшение сердечного выброса.
— Механизмы реализации .
— Расстройства энергетического, субстратного и кислородного обеспечения процесса синтеза белка в гепатоцитах.
— Развитие гипоальбуминемии, характерной для печёночной недостаточности.
— Падение эффективной онкотической всасывающей силы.
— Увеличение транспорта жидкости из микрососудов в интерстиций.
Таким образом, развитие отёка при сердечной недостаточности является результатом сочетанного и взаимопотенцирующего действия всех патогенетических факторов: гидродинамического, осмотического, онкотического, мембра-ногенного и лимфогенного.
Патогенез Вид отеков
Воспалительный отек (все механизмы), сердечный (кроме механического фактора), идиопатический (неизвестна причина)
Гидродинамический ® Отек легких (левожелуд.недостаточность)
#image.jpgМембранный ®Аллергический, Токсический, Неврогенный,
Отек-набухание головн.мозга, Легких (токсич.)
#image.jpgОсмотический ®Почечный ( нефроз)
#image.jpgПочечный(нефрит)
Онкотический ®Голодный (кахектический)
Лимфатический ®Лимфогенный (застойный)
1. ВОСПАЛИТЕЛЬНЫЙ: альтерация тканей и сосудов – венозная гиперемия и стаз + БАВ-повышение сосудистой проницаемости + гидролиз макромолекул – повышение тканевых рОсм и рОнк – набухание тканей – вено- и лимфостаз. Механизмы . мембранный, гидродинамический и осмотическимй, онкотический, лимфатический.
2. АЛЛЕРГИЧЕСКИЙ: анафилаксия – БАВ (гистамин) – Механизм . мембранный.
3. ТОКСИЧЕСКИЙ: хлор – легкие и пр. Механизм . мембранный.
4. ГОЛОДНЫЙ (кахетический): белковый дефицит, раковая кахексия, снижение рОсм – мало белков плазмы. Механизм осмотический.
5. ЛИМФОГЕННЫЙ: застой лимфы – рубец, опухоль, воспаление, закупорка (филляриоз) – повышение рГидростат. Лимфы нарушает отток из ткани. Механизм . лимфатический.
6. НЕВРОГЕННЫЙ: преобладание резкое вазодилятации с повышением проницаемости сосудов (болезни нервной системы). Механизм . мембранный.
7. ИДИОПАТИЧЕСКИЙ (неизвестного генеза): у женщин чаще, на голенях, веках, кистях к концу дня летом, ортостатические отеки.
8. СЕРДЕЧНЫЙ ОТЕК: при сердечной недостаточности – снижение МОК и первичная циркуляторная гипоксия:
а) Первично: сердечная недостаточность – повышение венозного давления и торможение резорбции жидкости; повышение ОЦК и увеличение фильтрации в артериолах жидкости в ткани. Циркуляторная гипоксия – ацидоз, повышение выхода белка– повышение рОнк ткани
б) динамическая лимфатическая недостаточность,
в) снижение сердечного выброса (и повышение ОЦК) – волюморецепторы сосудов – рефлекторное сужение почечных артерий (только коры почек) – сброс крови в медуллярный кровоток (канальцы)- возрастание реадсорбции Na + (закрепляется альдостероном) – внеклеточная гиперосмия – осморецепторы ткани – АДГ – усиление реадсорбции воды – задержка в тканях воды и жидкости.
г) снижение кровотока в почках – ренин – альдостерон.
д) снижение МОК – циркуляторная гипоксия – повышение проницаемости капилляров – выход плазмы – отек ткани.
е) повышение рОсм тканей (венозно-лимфатическая недостаточность + задержка ионов + ацидоз – гидролиз неферментный).
ж) венозная гиперемия (недостаточность сердца) – застой в печени – снижение синтеза альбуминов – снижение рОнк – отек.
Механизмы . гидродинамический, осмотический, мембранный, лимфатический и онкотический.
Схема 5 Патогенез сердечного отека
СЕРДЕЧНАЯ НЕДОСТАТОЧНОСТЬ ® СНИЖЕНИЕ МОК
Снижение поче- Активация волюмо- Циркуляторная Венозная
чного кровотока рецепторов сосудов гипоксия гипертензия
Ренин Сужение сосудов почек Нарушение Застой
¯ ¯ лимфоотока в печени
#image.jpg#image.jpg Альдостерон Сброс крови в медул- ¯
#image.jpg ¯ лярные нефроны Снижение
Na+ реабсорбция синтеза белка
Осморецепторы Гипоонкия
#image.jpgВода – реабсорбция ОТЕК ТКАНИ
9. ОТЕК ЛЕГКИХ: быстрое развитие, к острой общей гипоксии.
А) Токсический: мембранный фактор (легочные яды – хлор, О2); ведут к ацидозу, повышению гидролитических ферментов, образованию «каналов» между округлившимися поврежденными клетками эндотелия.
Б) Левожелудочковая недостаточность (инфаркт, порок аортальный и митральный стеноз, экссудативный перикардит, гипертонический криз, аритмии – пароксизмальная желудочковая тахикардия, горная болезнь, нейрогенные – при отеке мозга) — Возрастание давления в левом предсердии и в малом круге (легочная гипертензия) – транссудация жидкости в альвеолы (гидродинамический фактор).
В патогенезе дыхательный алкалоз (учащение дыхания) сменяется дыхательным ацидозом (снижение обмена газов).
10. ПОЧЕЧНЫЕ ОТЕКИ:
А) Нефротический: деструкция ткани почки (гломерулосклероз, сахарный диабет, амилоидоз, интоксикации, аутоиммунная патология) – резкая протеинурия (нефротический синдром) – снижение рОнк плазмы с отеком ткани + гиповолемия с повышением ренин-альдостерона – Na+ — АДГ – вода. Механизм: онкотический и затем осмотический. Присоединяется и лимфо-венозная недостаточность.
Схема 6 Патогенез легочного отека (при сердечной недостаточности)
ЛЕВОЖЕЛУДОЧКОВАЯ НЕДОСТАТОЧНОСТЬ
Патогенез отека легких при левожелудочковой сердечной недостаточности.
Патогенез отека легких при левожелудочковой сердечной недостаточности. — раздел Химия, ПАТОФИЗИОЛОГИЯ ВОДНО-СОЛЕВОГО ОБМЕНА Ослабленная Левая Половина Сердца Не Справляется С Перекачиванием Крови Из Ма.
Ослабленная левая половина сердца не справляется с перекачиванием крови из малого круга кровообращения в аорту. В малом круге развивается венозный застой, растет давление крови (прежде всего в венах и капиллярах). Капиллярное и венозное русло расширяется, т.е. увеличивается фильтрационная поверхность. Повышение гидростатического давления в капиллярах ведет к увеличению транссудации и уменьшению резорбции жидкости из интерстиция. Возникает угроза интерстиционального отека легких. Однако, как правило, у некоторых больных какое-то время этому препятствуют следующие приспособительные механизмы:
Рефлекс Китаева -в ответ на повышение давления в легочных венах и левом предсердии усиливается тонус легочных артерий. Это уменьшает поступление крови в капилляры легких. Венозный застой уменьшается. Правый желудочек вынужден усиливать сокращения для преодоления повысившегося сопротивления в легочных артериях. В полости правого желудочка и легочных артериях повышается давление. В ответ на это включается Рефлекс Парина.
Рефлекс Парина - итак, сигнализация о высоком давлении в правом желудочке и легочных артериях поступает в гипоталамус (передний отдел -по блужд. нерву). В ответ на это снижается эфферентная симпатическая импульсация к сосудам большого круга -они расширяются, АД снижается, часть крови депонируется в венозном русле. Этому способствует брадикардия. В результате этого приток крови к сердцу падает и снижается опасность отека легких.
Однако эти механизмы защиты могут отсутствовать у некоторых больных или могут оказаться недостаточными, например, при физическом напряжении, стрессах. Основная патология -левожелудочковая недостаточность -служит базой для возникновения стресса, одним из пусковых факторов которого является циркуляторная гипоксия. Если к этому присоединяется какое-либо эмоциональное напряжение, то непременно последует выраженная вазоконстрикция большого круга с перераспределением больших объемов крови в малый круг. К тому же повышение общего периферического сопротивления из-за вазоконстрикции значительно увеличивает нагрузку на левый желудочек, несостоятельность которого еще больше усиливается.
При стрессовой ситуации за счет тахикардии укорачивается диастола и, поэтому отток из легких становится меньшим. Это ведет ко все большему венозному застою в малом круге. стресс увеличивает потребности организма в О 2 . но левое сердце ослаблено, что ведет к усилению гипоксии и в силу этого к усилению самого стресса. Интенсивное стимулирование сердечно-сосудистой системы гормонами и медиаторами стресса заставляет правый желудочек вступать в противоречие с работой левого.
Разница в выбросе желудочков, перегрузка левого сердца вазоконстрикцией и перераспределение крови из большого в малый круг ведут к острому подъему гидростатического давления в малом круге с выходом жидкости в интерстиций.
Транссудации способствуют и повышению проницаемости капиллярного русла, связанное с нарастающим содержанием биологически активных веществ в крови у больных с циркуляторной гипоксией и венозным застоем в легких, а также с тем, что увеличивается расстояние между эндотелиальными клетками капилляров. Значительное возбуждение симпатической нервной системы ведет к лимфоангиоспазму, что еще больше увеличивает содержание жидкости в интерстиции.
Итак, формируется интерстициональный отек легких, клиническим эквивалентом которого является тяжелейшая одышка, вплоть до сердечной астмы. Чем больше нарушена функция левого желудочка, тем меньшая степень напряжения сердечно-сосудистой системы и организма вызывает отек легких.
Другой патогенетический фактор, о котором следует сказать, заключается в следующем: при левожелудочковой сердечной недостаточности развивается частичная обструкция нижних дыхательных путей. Просвет нижних дыхательных путей, особенно, бронхиол, мелких бронхов может суживаться за счет венозного полнокровия слизистой оболочки и отека. Это возможно потому, что 2/3 крови, притекающей по бронхиальным сосудам, оттекает в вены малого круга, в котором повышено гидростатическое давление из-за венозного застоя. А так как бронхиальные артерии принадлежат большому кругу, естественно, в них высокое гидравлическое давление, что ведет к выраженному венозному полнокровию слизистой оболочки и отеку ее.
Кроме того, вокруг бронхиол могут образовываться своеобразные муфты, дополнительно сдавливающие бронхиолы снаружи. Их образование в этих условиях объясняется чисто анатомическими особенностями кровоснабжения адвентиции. При венозном застое венозное сплетение набухает и сдавливает бронхиолу. Кроме того, отек слизистой бронхов усиливается только потому, что из-за циркуляторной гипоксии повышается проницаемость сосудов бронхов.
Сужение нижних дыхательных путей ведет к увеличению сопротивления при вдохе, что способствует развитию более отрицательного давления в фазу вдоха, как в альвеолах, так и в интерстициальном пространстве легких (т.е. в том числе вокруг внеальвеолярных сосудов, в норме оно минус 3 -8 мм.рт.ст. при полном закрытие воздухоносных путей во время вдоха давление может упасть до минус 70 мм.рт.ст.).
Гидравлические силы внутри внеальвеолярных сосудов становятся относительно больше, т.е. увеличивается фильтрационное давление, что и облегчает транссудацию, в первую очередь, в интерстициальное пространство. Сюда же на первых порах, дренируется жидкость из межальвеолярных перегородок.
И все это разворачивается на фоне переполненного кровью малого круга.Транссудат не выходит сразу в альвеолы потому, что альвеолярный эпителий более непроницаем, чем капиллярный эндотелий, и наличие, до поры до времени, полноценного сурфактанта тоже препятствует транссудации жидкости в альвеолу. Все разобранное ведет к развитию преимущественно интерстициального отека легких. Следующие патогенетические факторы принимают участие в формировании альвеолярного отека легких. Это повышение проницаемости аэро-гематического барьера. Известно, что поверхностное натяжение жидкости, выстилающей альвеолы, создает значительные силы, стремящиеся их сплющить. Эти силы снижают и давление вокруг альвеолярных капилляров. Силы поверхностного натяжения поэтому при соответствующих условиях вызывают не только спадение альвеол, но и “засасывание” в них жидкости из капилляров и интерстиция. Однако сурфактант уменьшает силы поверхностного натяжения и тем самым повышает стабильность альвеол и препятствует проникновению жидкости в альвеолы. Однако сурфактант легко разрушается при нарушениях кровообращения и, в частности, при венозном застое, при хронической гипоксии (гиповентиляция).
Проницаемость аэро-гематического барьера нарастает и потому, что высокое внутрисосудистое давление приводит к разрыву плотных соединений не только между эндотелиальными, но и между альвеолярными клетками, покрывающими альвеолярные капилляры. Эти же силы разрывают и мембрану.
Итак, жидкость появилась в просвете альвеол. Здесь она вспенивается. А т.к. вместе с транссудатом вымываются остатки сурфактанта, он придает пене стабильность. Альвеолы могут быть лишены полностью вентиляции. В тех альвеолах, где сурфактанта нет, может быть полное заполнение транссудатом, а в тех, где он есть -будет пена. С началом пенообразования резко сокращается воспроизводство сурфактанта из-за местной гипоксии альвеол. Это ведет к прогрессированию отека легких.
Принципы терапии .
1. Уменьшить кровенаполнение малого круга. Это достигается, в частности, путем перераспределения крови из малого в большой круг, следующими приемами:
а) придать больному сидячее положение;
б) расширить сосуды большого круга -для этого снизить активность симпатической н.с. С этой целью -купировать стресс, сосудорасширители -в частности нитроглицерин.
в) кровопускание;
г) депонирование крови в конечностях - жгуты;
д) усилить диурез;
е) удерживать АД в большом круге на не высоком уровне (не выше 100 мм.рт.ст.) - т.к. 2/3 крови, притекающей по бронхиальным артериям оттекает в легочные вены и половина отечной жидкости в легких накапливается при участии бронхиальных сосудов.
2. Стабилизировать проницаемость сосудов малого круга и аэробо-гематического барьера.
3. Улучшить газообмен -пеногашение, искусственная вентиляция, оксигенотерапия.
Патогенез отеков при правожелудочковой сердечной недостаточности .
Ослабленный правый желудочек не справляется с перекачиванием крови из полых вен в малый круг. В полых венах задерживается много крови. В венах нарастает давление. В аорту выбрасывается меньший систолический объем -артериальная гиповолемия -> ренин -> ангиотензин II ‑> альдостерон -> задержка Na -> АДГ -> задержка Н 2 О. В ответ на гиповолемию с волюмрецепторов может напрямую происходить стимуляция секреции АДГ и, если задержка воды окажется чуть больше, чем задержка Na, то в крови будет наблюдаться гипонатриемия, однако осмолярность плазмы остается в норме за счет увеличения количества мочевины и креатинина. Поэтому клеточная гипергидратация не развивается. Возникает олигурия из-за увеличения секреции АДГ. Т.к. в полых венах нарастает давление, то, естественно, растет гидростатическое давление в венозной части капилляров, что затрудняет резорбцию жидкости из интерстиция. Накоплению воды при сердечной недостаточности способствует и снижение продукции Na-уретического гормона. Нарушается лимфоотток, т.к. грудной лимфатический проток впадает в систему верхней полой вены, где давление повысилось и, естественно, это способствует накоплению интерстициональной жидкости.
В дальнейшем, из-за застоя нарушается функция печени, подключается следующий патогенетический фактор -снижение онкотического давления в кровеносном русле. Кроме того, пораженная печень хуже разрушает альдостерон, что еще более усиливает задержку Na.
Отеком называют скопление жидкости в тканях , преимущественно в межклеточном пространстве вследствие нарушения водного обмена. Скопление жидкости в серозных полостях носит название водянки. Отек кожи называют anasarca, водянку брюшную - ascites, водянку перикардия - hydropericardhim, грудную - hydrothorax, внутричерепную - hydrocephalus, мошонки - hydrocoele.
Признаками отека являются увеличение объема ткани и изменение ее формы и напряжения, особенно обнаруживаемое при отеке кожи. Наблюдается побледнение и похолодание ее поверхности. При надавливании на отечную ткань пальцем остается ямка, которая медленно выравнивается.
Отечная жидкость характеризуется низким удельным весом и незначительным содержанием белка (обычно 0,3%). Количество белка в отечной жидкости варьирует в зависимости от характера отека и его патогенеза.
Образование отечной жидкости происходит вследствие фильтрации кровяной плазмы через полупроницаемую стенку сосудов и последующей задержки ее в ткани в основном ввиду разности коллоидно-осмотических давлений плазмы и тканевой жидкости.
Комплекс изменений в притоке и оттоке тканевой жидкости или лимфы лежит в основе патогенеза отека .
Патогенез отеков . В механизме возникновения отеков важная роль принадлежит усилению транссудации жидкости из сосудов в ткань и задержке жидкости тканью . Затрудненный же отток по лимфатическим сосудам хотя и способствует развитию отека, но играет второстепенную роль. Это объясняется наличием большого количества коллатеральных лимфатических путей, а также оттоком тканевой жидкости и по венам. Таким образом, отеки возникают вследствие расстройства водного обмена между кровью и тканями.
Обмен воды между кровью и тканями зависит от трех коллоидных систем: крови, соединительной ткани (межуточного вещества) и клеточной протоплазмы (рис. 44). Величина кровяного давления и скорости кровотока, физико-химические свойства среды по обе стороны сосудистой и клеточной мембран и свойства самих мембран определяют количество и состав жидкости, которая поступает из сосудов в ткань и обратно. Направление движения жидкости по обе стороны капиллярной стенки зависит от взаимоотношения гидродинамического и коллоидно-осмотического, или онкотического, давлений.
В нормальных условиях в артериальной части капилляра гидродинамическое давление (35 - 40 мм рт. ст.) выше коллоидно-осмотического (25 - 30 мм рт. ст.) и ток жидкости направлен из крови в ткань. В венозной части капилляра коллоидно-осмотическое давление (25 - 30 мм рт. ст.) становится выше гидродинамического (15 - 16 мм рт. ст.) и вследствие этого жидкость поступает из ткани в кровь (рис. 45).
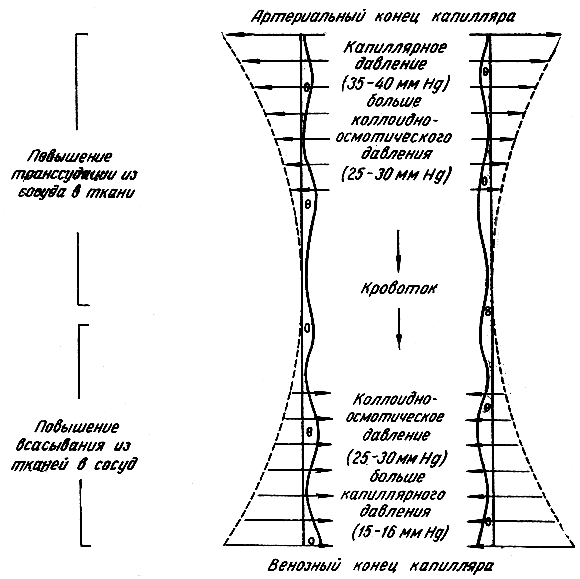
Отек развивается вследствие изменений: 1) гидродинамического (или механического) фактора - капиллярного давления и скорости кровотока и 2) физико-химических факторов, в основном коллоидно-осмотического (или онкотического ), отчасти осмотического давления крови и тканевой жидкости и обусловленного этим нарушения способности тканевых коллоидов связывать воду (набухать). В каждом конкретном случае то один, то другой из этих факторов может преобладать в возникновении отека. Однако указанные факторы не исчерпывают всех возможностей образования отека. Повышение проницаемости самой стенки капилляров также имеет весьма важное значение в патогенезе отека.
Гидродинамический фактор определяется повышением капиллярного давления, которое зависит не столько от артериального, сколько от венозного давления. Давление в венозной части капилляров может повышаться до 25 - 40 мм рт. ст. вместо 15 - 16 мм рт. ст. Эти изменения ведут к усилению фильтрации жидкости из крови в ткань (рис. 46). Повышение кровяного давления и замедление кровотока в капиллярах имеют место при патологических состояниях сопровождающихся венозным застоем, например при затруднении оттока крови из нижележащих частей тела вследствие недостаточности притока крови к правому желудочку сердца или закупорки вен нижних конечностей.

Усиленное образование тканевой жидкости при венозных застоях можно показать в опыте на собаке. В периферический конец одного из лимфатических сосудов, лежащих вблизи v. saphenae magnae, вставляют канюлю. Через 15 - 20 минут, после того как конечность перетянут эластичным бинтом, начинается отделение лимфы. Увеличенное образование лимфы, ее накопление в тканях и образование отека являются следствием повышения капиллярного давления, повреждения сосудистых стенок и ткани, а также затруднения оттока лимфы в результате развившегося венозного застоя.
Одно только повышение давления в капиллярах, например при артериальной гиперемии, несмотря на повышенное образование тканевой жидкости, еще не вызывает отека тканей, но в сочетании с венозным застоем артериальная гиперемия может способствовать развитию отека. Например, зажатие бедренной вены у собаки само по себе не вызывает отека, но одновременная перерезка седалищного нерва той же конечности, вызывая развитие артериальной гиперемии, ведет к развитию отека.
Другим весьма существенным фактором, вызывающим отек, является понижение коллоидно-осмотического давления плазмы, а также относительно увеличенная по сравнению с коллоидами крови способность тканевых коллоидов связывать воду. В этом отношении основное значение имеют белки. Для белков плазмы капиллярная стенка непроницаема. Поэтому даже незначительное понижение коллоидно-осмотического давления белков плазмы создает перевес гидродинамического, или механического, давления над коллоидно-осмотическим и является эффективным фактором усиления перехода воды из крови в ткань (рис. 47).

Способность же тканевых коллоидов связывать воду, или набухать, находится в зависимости от свойств самих коллоидов и от влияния на них электролитов, в частности концентрации водородных ионов.
У некоторых отечных больных наблюдается уменьшение коллоидно- осмотического давления плазмы. Последнее зависит не только от уменьшения общего количества белка в ней (гипопротеинемия), но и от изменения соотношения между белками плазмы, например уменьшения содержания альбуминов и относительного преобладания глобулинов, как это имеет место при некоторых заболеваниях почек (нефрозы).
Понижение содержания белков в плазме до 5,5 г% или альбуминов до 2,5 г% может повести к возникновению отека. Развитие отека наблюдалось при кормлении крыс безбелковой пищей и уменьшении при этом альбуминов плазмы. При возобновлении дачи белков с пищей содержание альбуминов в плазме повышалось и отек исчезал. В других опытах (над собаками) удавалось при помощи повторных кровопусканий и введения в кровяное русло отмытых эритроцитов вызывать понижение содержания белков в плазме до 3 г%. При этом развивался отек подкожной клетчатки.
Однако понижение коллоидно-осмотического давления плазмы само по себе не всегда ведет к развитию отека. Требуется наличие и других факторов. Клинические наблюдения показали, что иногда у больных низкое коллоидно-осмотическое давление плазмы не сопровождается появлением отека. Для понимания патогенеза отека необходимо рассматривать основные факторы, принимающие участие в возникновении отека, не изолированно, а в их взаимодействии друг с другом.
Хотя в патогенезе отека играет роль не один, а несколько факторов, их значение для возникновения отдельных видов отека все же не одинаково. В зависимости от преобладающего значения одного из этих факторов различают по патогенезу отеки гидродинамические (механические) и коллоидно-осмотические. Но часто нелегко бывает решить, к какому из этих видов относится отек, так как не удается установить, какой именно фактор является преобладающим.
Большое значение в возникновении отека имеет также состояние стенок капилляров - повышение проницаемости их, в частности по отношению к белкам.
Нарушение проницаемости сосудов в эксперименте удается получить при изменении функции вазомоторов, нарушениях тканевого обмена или действии отравляющих веществ. Например, у лягушки можно вызвать отек половины языка, если длительно раздражать электрическим током возрастающей силы сосудорасширяющий язычный нерв. Проницаемость сосудов заметно повышена при воспалении, заболеваниях почек, авитаминозе С, отравлении азотнокислым серебром, ураном, мышьяком.
Важно отметить, что действие перечисленных выше патогенетических факторов отека в своем возникновении зависит от нарушений функции нервной системы , так как нервная система регулирует и гемодинамику, и тканевый обмен, и сосудистую проницаемость. Так, в эксперименте было показано, что введение кролику больших количеств физиологического раствора (в несколько раз больше объема его крови) само по себе отека не вызывает. Если же такое воздействие сочетать с раздражением интерорецепторов кишечной петли, сохранившей с организмом только нервные связи, то очень быстро (через 3 - 8 минут) развивается сильнейший отек легких. То же самое получится, если добавочное раздражение нанести на центральный конец блуждающего нерва или вызвать травму головного мозга.
В патогенезе отеков принимают также участие эндокринные железы , регулирующие водный обмен (гипофиз и щитовидная железа). В последнее время установлена связь отеков (особенно сердечных и почечных) с нарушением функции коры надпочечников. Усиленное выделение минералокортикоидов вызывает задержку в организме гидрофильного натрия. В этом отношении наибольшей способностью обладает альдостёрон: он усиливает обратное всасывание натрия в извитых канальцах почек и подавляет все другие пути его выделения из организма.
Действительно, увеличенное количество альдостерона обнаруживается в крови и моче у больных с поражением сердца или почек, страдающих отеком. Причина же усиленного выделения альдостерона еще не ясна. Имеются некоторые данные, что при начинающемся отеке усиленное выделение альдостерона надпочечниками может быть вызвано уменьшением объема крови и вследствие этого раздражением рецепторов объема или барорецепторов каротидного синуса, правого предсердия или непосредственно промежуточного мозга.
Этиология отеков . Помимо подразделения отеков по патогенезу, их делят в зависимости от причины возникновения по этиологии на следующие виды: застойные, сердечные, почечные, кахектические, токсические, воспалительные, нервно-трофические, эндокринные .
К числу отеков застойного происхождения относятся отеки , возникающие от закупорки вен (при тромбозах и эмболиях) или сдавления их опухолью, например отек ног у беременных и некоторые другие. По своему патогенезу такие отеки в основном являются гидродинамическими. Сердечные отеки издавна объясняли расстройством сердечной деятельности, повышением капиллярного давления от венозного застоя и увеличением транссудации жидкости из крови в ткань. Одновременно наблюдается затруднение оттока жидкости из ткани вследствие ослабления присасывающей силы правого сердца. Ранее всего застойные отеки проявляются в тех местах, где имеется относительно большая сопротивляемость оттоку крови, например в нижних конечностях. Но повышение капиллярного давления недостаточно для развития сердечного отека.
В возникновении сердечного отека играет также роль увеличение проницаемости капилляров в результате гипоксии и нарушения питания их стенок., При сердечных отеках оказывается нарушенным и коллоидно-осмотическое давление, так как недостаточность сердечной деятельности нарушает обмен веществ и физико-химическое состояние крови и ткани. В патогенезе сердечных отеков имеет также большое значение вторичный гиперальдостеронизм, возникающий рефлекторно вследствие уменьшения минутного объема сердца и перераспределения крови. В результате происходит усиление реабсорбции натрия и задержка воды в организме.
Почечные отеки , особенно выраженные при нефрозах, имеют в механизме своего возникновения главным образом снижение содержания белков в крови - гипопротеинемию, т. е. разжижение плазмы и вследствие этого уменьшение ее коллоидно-осмотического давления. Почечные отеки при гломерулонефритах объясняются нарушением коллоидных свойств тканей и повышением проницаемости сосудов для белка вследствие отравляющего действия токсических веществ, накопляющихся в организме. В патогенезе почечных отеков при гломерулонефритах имеет также значение повышение капиллярного давления и нередко сочетание этого заболевания с сердечной недостаточностью. Вторичный гиперальдостеронизм, возникающий вследствие гиповолемии, также играет роль в патогенезе почечных отеков.
Кахектические отеки развиваются при истощении организма в результате хронических заболеваний, например при тяжелом малокровии, злокачественных опухолях, качественном голодании. В происхождении этих отеков главную роль играет повышение проницаемости сосудов, уменьшение содержания белков в крови вследствие недостаточного их синтеза или поступления в организм. В результате этого коллоидно-осмотическое давление в плазме понижается, она легче фильтруется через капилляры, а резорбция тканевой жидкости уменьшается. Накоплению воды (при голодании и кахексии) способствует нарушение тканевого обмена, ведущее к задержке воды соединительной тканью.
Токсические отеки развиваются от действия различных токсических веществ. Развитие этих отеков объясняется повреждением сосудистых стенок и повышением коллоидно-осмотического давления в тканях. Токсические отеки кожи возникают на месте укуса некоторых насекомых, от действия горчичного или кротонового масел, в легких - от вдыхания хлора, фосгена и особенно дифосгена.
Воспалительные отеки близки по патогенезу к токсическим. В происхождении воспалительных отеков основную роль играют повышение проницаемости сосудистой стенки, а также повышение коллоидно-осмотического давления в тканях и повышение капиллярного давления. Отечность тканей воспалительного происхождения наблюдается при инфекционных поражениях, например при гнойных процессах в коже, дифтерии, скарлатине, особенно при сибирской язве и действии некоторых отравляющих веществ (иприта и люизита).
К числу отеков, возникающих вследствие поражения нервной системы, относятся отеки сосудистотрофического происхождения , например отек конечностей при гемиплегиях и сирингомиелиих 1 , отек лица при невралгии тройничного нерва, отек Квинке 2 при ранениях или сдавлении нервов, отеки кожи у людей, больных истерией. В происхождении нервных отеков ведущая роль принадлежит нарушению иннервации сосудистых стенок, которое влечет за собой изменение их проницаемости. При этом имеет также значение нарушение обмена веществ в тканях. Встречаются отеки, возникающие в связи с расстройством функции желез внутренней секреции , например щитовидной железы. Гипотиреоидные отеки возникают, вероятнее всего, от резкого нарушения питания тканей и свойства их коллоидов.
1 (Заболевание, характеризующееся разрастанием глиозной ткани и образованием полостей в сером веществе спинного мозга. )
2 (Заболевание, характеризующиееся периодическими ограниченными отеками кожи и слизистых оболочек. )
Исход отеков зависит от течения того патологического процесса, который вызвал задержку воды в тканях. После устранения причины жидкость, скопившаяся в тканях, рассасывается. Однако при длительных отеках иногда наблюдается потеря эластичности ткани. Вследствие этого после удаления причины, вызвавшей отек, спадения ткани не происходит, и жидкость остается в ней на продолжительное время.
Последствия отека для организма заключаются в нарушении функции органов. Это объясняется сдавлением клеток скопившейся в ткани жидкостью и изменением жизнедеятельности их. При водянке скопление жидкости в какой-либо полости нередко влечет за собой сдавление окружающих органов и тканей. Особенно имеет значение нарушение деятельности органов от скопления жидкости в местах, важных в функциональном отношении. Так бывает при отеке легких, когда жидкость скопляется в альвеолах. Благодаря этому дыхательная поверхность легких может значительно уменьшиться.
Отечные ткани легко подвергаются инфекции, и в них часто возникают воспалительные процессы. Например, отек легких может повлечь за собой развитие воспаления легких. Длительный отек вследствие вызываемой им гипоксии ткани и накопления в ней СО 2 может повести к разрастанию соединительной ткани.
При отеке в результате нарушений водно-электролитного обмена в тканях может скапливаться огромное количество жидкости. В этом процессе принимает участие ряд механизмов:
При увеличении гидростатического давления выпотевание жидкости идет преимущественно за счет нарастания эффективного фильтрационного давления (рис. 12.3).
2. Повышение проницаемости сосудов происходит за счет образующихся в организме биологически активных веществ (гистамин, серотонин, кинины, простагландины), а также в результате действия на организм ядов змей, насекомых, отравляющих веществ. Повреждение капиллярной мембраны даже в условиях нормального гидростатического и онкотического давления вызывает значительную диффузию воды, электролитов и белков ткани.
3. Уменьшение онкотического давления плазмы крови обусловлено уменьшением количества белков, преимущественно альбуминов, которые обладают в 2-4 раза большей онкотической активностью, чем глобулины.
Гипопротеинемия ниже 5г % ведет к диффузии воды за пределы сосудистого русла и развитию гипоонкотического отека. Основу этого явления составляет увеличение эффективного фильтрационного давления в капиллярах.
Три основные группы причин вызывают гипопротеинемию:
а) нарушение синтеза и усиление распада белка (при голодании, сердечной недостаточности, поражении печени). Такие отеки, формирующиеся при голодании, получили название голодных отеков;
б) значительные потери белка также ведут к гипопротеинемии. Это наблюдается при нефротическом синдроме, при обширных ожогах, абсцессах;
в) введение с лечебной целью большого количества жидкости.
4. Исключительно важным механизмом формирования отека является задержка натрия в организме. Этому способствует поражение почек и нарушение его выделения с мочой. В регуляции натриевого обмена важное значение принадлежит альдостерону и глюкокортикоидам. По способности задерживать натрий за счет реабсорбции в дистальных канальцах почек альдостерон в 25-30 раз сильнее ДОКс и более чем в 300 раз активнее кортизола. Однако, учитывая, что кортизола образуется в 60 раз больше, чем альдостерона, минерал кортикоидные эффекты кортизола весьма значительные и не учитывать их нельзя (А.Х. Бабаева с соавт.).
5. Влияние антидиуретического гормона. Антидиуретический гормон выполняет ведущую роль в регуляции проницаемости дистальных отделов почечных канальцев для воды и транспорта натрия. Механизм действия антидиуретического гормона сложен. Его эффекты объясняются несколькими гипотезами. Считают, что под влиянием этого гормона увеличивается диаметр пор наружной мембраны клеток дистальных канальцев, через которые усиливается реабсорбция воды; по другим данным, АДГ стимулирует гиалуронидазу, вследствие чего происходит деполимеризация гиалуроновой кислоты межклеточного вещества, повышается проницаемость и по осмотическому градиенту всасывается вода.
Натрийуретическое действие АДГ связывают с повышенным синтезом 3,5-АМФ. Диуретический и натрийуретический эффект АДГ проявляется только при участии гормонов гипофиза и надпочечников, ибо при гипофизэктомии эффекты АДГ ослабляются.
Антидиуретический и натрийуретический эффекты не являются неразрывно связанными, ибо при длительном введении вазопрессина антидиуретический эффект продолжается многие часы, а выделение с мочой натрия (натрийурез) более кратковременен (З.И. Гершкович).
Высказывается мнение, что натрийурез вызывается угнетением продукции минералкортикоидов и обусловлен задержкой воды в тканях.
В условиях патологии увеличение эффектов АДГ может быть вызвано усиленным образованием его в задней доле гипофиза или гипоталамусе при развитии опухоли, нарушении метаболизма АДГ при недостаточности печени. В формировании отеков различного происхождения принимают участие все вышеперечисленные механизмы. Общие механизмы отека представлены на рисунке 12.4.
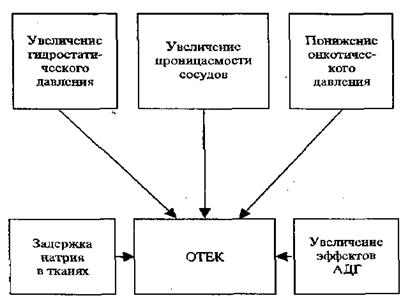 Рис. 12.4 Общие механизмы развития отека |
Дегидратация - явление, характеризующееся недостатком воды в организме. Выделяют два типа дегидратации (Керпель- Фрониус):
1. Потеря воды без эквивалентного количества катионов. Это сопровождается жаждой и перераспределением воды из клеток в интерстициальное пространство.
2. Потеря натрия. Компенсация воды и натрия происходит из экстрацеллюлярной жидкости. Характерным является нарушение кровообращения без развития жажды.
При дегидратации, вызванной полным голоданием, у людей снижается масса тела, уменьшается диурез до 600 мл/сутки, повышается удельный вес мочи до 1,036. Концентрация натрия и объем эритроцитов не изменяются. Одновременно возникает сухость слизистой оболочки рта, жажда, а в крови нарастает остаточный азот (А.У. Уилкинсон).
Уилкинсон А.У. предлагает классифицировать дегидратации на водную и солевую. Истинное «водное истощение, первичная или простая дегидратация» обусловлена недостатком воды и калия, в резуль
тате чего изменяется объем внутриклеточной жидкости, и характеризуется жаждой и олигурией. В этом случае первоначально повышается осмотическое давление интерстициальной жидкости, и поэтому вода переходит из клеток во внеклеточное пространство. В связи с развивающейся олигурией количество натрия поддерживается на стабильном уровне, а калий продолжает секретироваться в дистальных канальцах и выделяться с мочой.
Истинное «солевое истощение», вторичная или внеклеточная дегидратация связана, главным образом, с недостатком натрия и воды. В этом случае уменьшается объем плазмы и интерстициальной жидкости и увеличивается гематокрит. Поэтому основным проявлением является нарушение кровообращения.
Таблица 12.19
Ионный состав секретов пищеварительного тракта и плазмы
 |
Наиболее серьезные потери натрия встречаются в хирургической практике и обусловлены потерей желудочно-кишечного секрета через обширные раневые поверхности. Состав секретов пищеварительного тракта приведен в таблице 12.19.
Основными причинами солевой дегидратации являются потеря натрия с отсасываемым из желудка секретом (например, у оперированных больных), рвота, желудочно-кишечный свищ, непроходимость кишечника. Потеря натрия может привести к критическому снижению объема внеклеточной жидкости и плазмы и нарушению кровообращения, сопровождающегося гипотензией и уменьшением клубочковой фильтрации.
При дегидратации, вызванной как дефицитом воды, так и потерей натрия, нормализация водно-электролитного баланса достигается одновременным введением натрия и воды.

